8. Sınıf Fen Bilimleri Asitler ve Bazlar Konu Anlatımı
Çevremizdeki bazı maddeleri incelerken asitler ve bazlar olarak iki grupta inceleriz.
Asitler
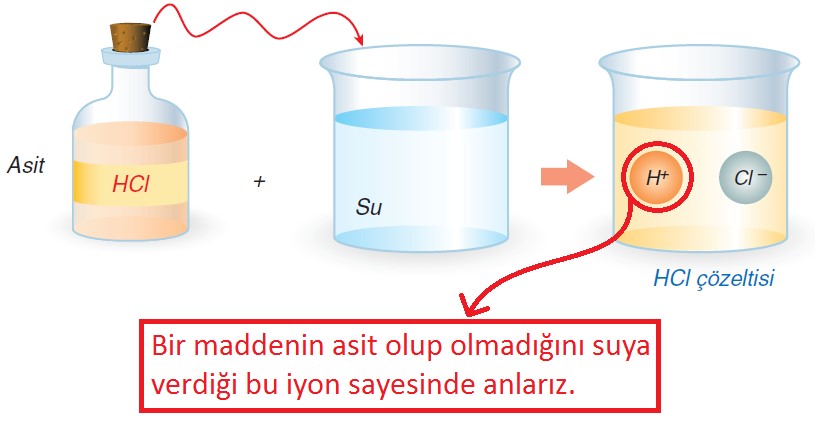
Sulu çözeltilerinde H+ iyonu veren maddeler asit olarak adlandırılır. Genellikle asitlerin formül yapısında hidrojen atomu (H) bulunur. Ancak, yapılarında H bulunmadığı hâlde CO2, NO2 ve SO2 maddeleri de asittir.
 Asitlerin
tatları genellikle ekşidir. Ancak her asidin tadına bakılmaz. Çünkü çok
tehlikeli olan asitler bulunmaktadır. Bazı asitler sanayide ve halk
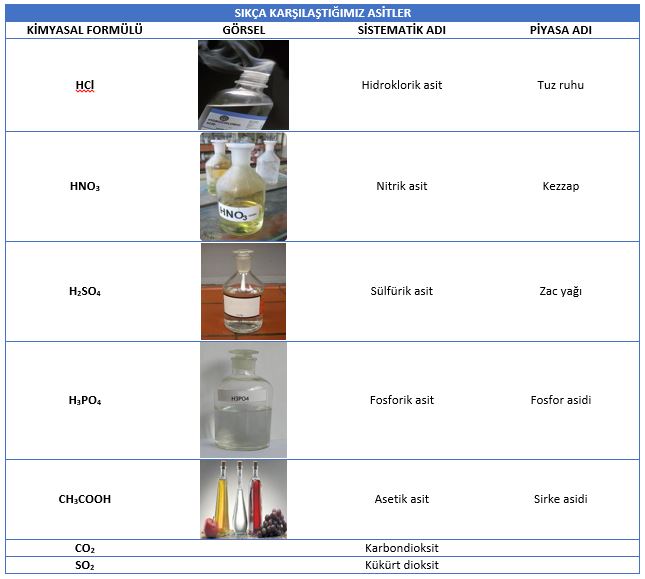
arasında sistematik adlarından farklı adlarla bilinirler. Sıkça
karşılaştığımız asitlerin formülleri ve adları aşağıda gösterilmiştir.
Asitlerin
tatları genellikle ekşidir. Ancak her asidin tadına bakılmaz. Çünkü çok
tehlikeli olan asitler bulunmaktadır. Bazı asitler sanayide ve halk
arasında sistematik adlarından farklı adlarla bilinirler. Sıkça
karşılaştığımız asitlerin formülleri ve adları aşağıda gösterilmiştir.
 Günlük
hayatta yiyecek ve içeceklerin yapısında da asitler yer almaktadır.
Aşağıda bu asitler ve bulundukları yerler verilmiştir.
Günlük
hayatta yiyecek ve içeceklerin yapısında da asitler yer almaktadır.
Aşağıda bu asitler ve bulundukları yerler verilmiştir.
Sanayide ve endüstride de yaygın olarak kullanılan bazı asitler şunlardır:
Fosforik asit: Gübrelerde ve ilaç yapımında kullanılır. Gıda koruyucu olarak ve gazlı içeceklerde kullanılmaktadır.
Nitrik asit: Çeşitli patlayıcılar, dinamit, azotlu gübre ve plastik yapımında kullanılmaktadır.
Hidroklorik asit: Banyo ve tuvaletlerde temizlik malzemesi olarak kullanılan bir asittir.
Sülfürik asit: Boya sanayisinde ve patlayıcı yapımında kullanılan bir asittir.
Not: Gazlı içecekler bol miktarda asit içermektedir. Bunun yanında gazlı içeceklerin çok fazla sayıda zararı bulunmaktadır. Gazlı içeceklerin bazı zararları aşağıdakilerdir:
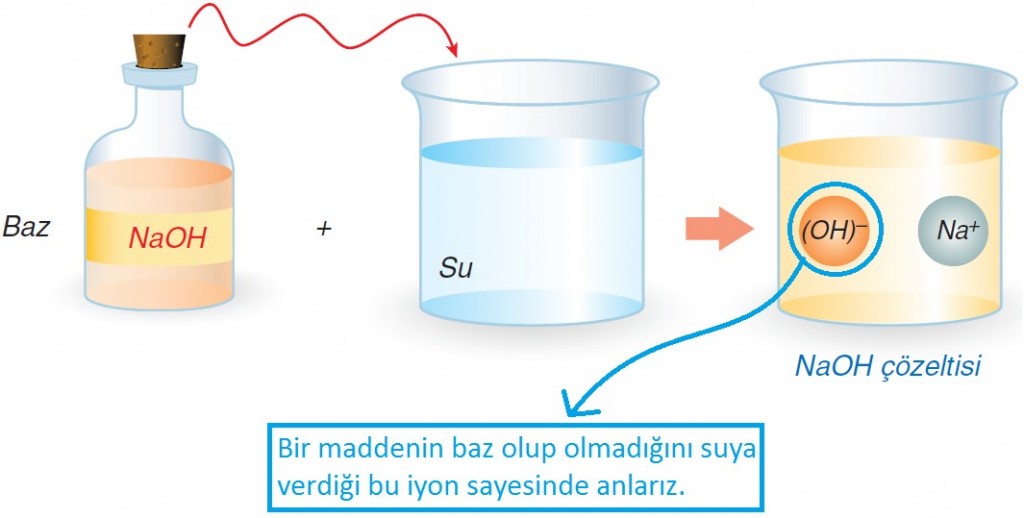
Sulu çözeltilerinde (OH)– iyonu veren maddeler baz olarak adlandırılır. Genellikle bazların yapısında hidroksit (OH) iyonu bulunur. Ancak, OH bulunmayan amonyak (NH3) ise bazdır. NH3 susuz baz olarak da adlandırılır.
 Bazların
tatları genellikle acıdır. Ancak her bazın tadına bakılmaz. Çünkü çok
tehlikeli olan bazlar bulunmaktadır. Bazı bazların sanayide ve halk
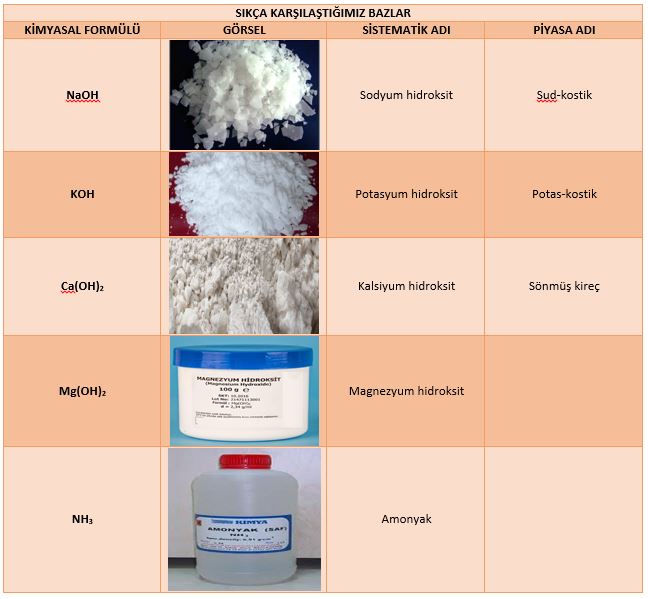
arasında sistematik adlarından farklı adlarla bilinirler. Sıkça
karşılaştığımız bazların formülleri ve adları aşağıda gösterilmiştir.
Bazların
tatları genellikle acıdır. Ancak her bazın tadına bakılmaz. Çünkü çok
tehlikeli olan bazlar bulunmaktadır. Bazı bazların sanayide ve halk
arasında sistematik adlarından farklı adlarla bilinirler. Sıkça
karşılaştığımız bazların formülleri ve adları aşağıda gösterilmiştir.
 Sanayide ve endüstride de yaygın olarak kullanılan bazı bazlar şunlardır:
Sanayide ve endüstride de yaygın olarak kullanılan bazı bazlar şunlardır:
Sodyum hidroksit: Beyaz renkte ve nem çekici bir maddedir. Suda kolaylıkla çözünür; yumuşak, kaygan ve sabun hissi veren bir çözelti oluşturur. Sodyum hidroksit, endüstride birçok kimyasal maddenin yapımında; yapay ipek, sabun, kâğıt, tekstil, boya ve deterjan endüstrisinde kullanılır.
Potasyum hidroksit: Arap sabunu gibi bazı temizlik ürünlerinin yapımında kullanılır.
Kalsiyum hidroksit: Beyaz bir toz olup suda hamurumsu bir görünüş alır. Sönmemiş kirece su ilavesiyle elde edilir. Kireç ve çimento yapımında kullanılır.
Amonyak: Renksiz, kendine özgü keskin kokusu olan bir gazdır. Sıvı amonyak özellikleri bakımından suya benzer. Amonyak endüstride gübre, nitrik asit, üre, boya, ilaç ve plastik gibi organik madde imalatında kullanılır. Soğutucularda ve cam temizleme ürünlerinde bulunur.
Temizlik malzemelerinin üretiminde genellikle bazlar kullanılır. Bunun yanında Sodyum karbonat(çamaşır sodası), Sodyum sülfat (Na2SO4) ve Sodyum fosfat (Na3PO4) gibi maddelerin kir çıkarma özellikleri vardır. Piyasada satılan bulaşık deterjanlarının çoğunda bu maddeler bulunur.
Bazları asitlerden ayırt etmek için iki farklı yöntem kullanılır. Fenolftalein ve turnusol kâğıdı kullanmak.
pH ve pH Ölçme
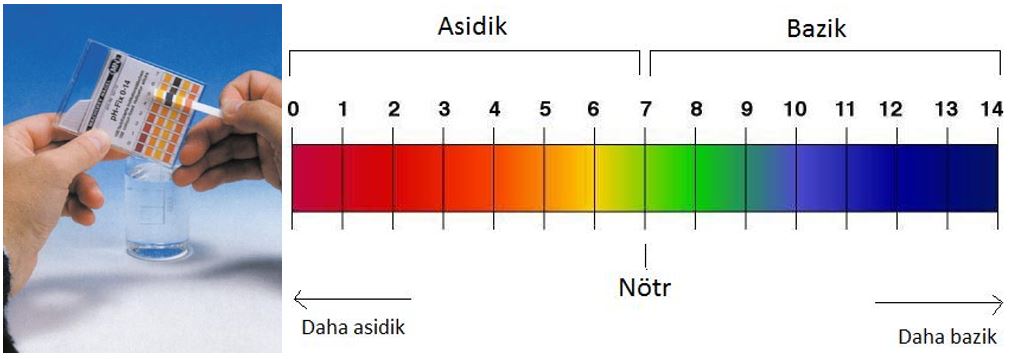
pH bir çözeltinin asitlik veya bazlık derecesini tarif eden ölçü birimidir. Açılımı “Power of Hydrogen” (Hidrojenin Gücü)’dir. Asit ve bazların pH değerlerine bakarak o asit ve bazın kuvvetli ya da zayıf olduğunu söyleyebiliriz. pH değeri 0 – 14 arasındaki değerlerden oluşur. Bir çözeltinin ne kadar asidik veya ne kadar bazik olduğunun ölçüsü pH değeri ile ifade edilir. Saf suyun asitlik veya bazlık özelliği yoktur. Bu nedenle pH’ı 7’dir. pH’ı 0-7 arasında olan maddeler asidik, pH’ı 7-14 arasında olan maddeler ise bazik olarak sınıflandırılır. pH değeri sıfırdan 7’ye doğru yükseldikçe maddenin asitlik özelliği azalır. pH’ın 7 olması maddenin asitlik ve bazlık özelliğinin olmadığını gösterir. pH 7’den itibaren sayı yükseldikçe maddenin bazlık özelliği artar.
Maddelerin pH değerlerini ölçmek için turnusol kağıdı ve pH ölçeğinden yararlanılır. Ölçme işlemi iki aşamada gerçekleşir:
 Bazı Ürünlerin pH Değerleri
Bazı Ürünlerin pH Değerleri
Kuvvetli asit ve bazlar yakıcı ve tahriş edici olup zehirlenmelere neden olabilir. Süt ve süt ürünlerinden sebze ve meyvelere, ekmekten deniz ürünlerine kadar hemen her şeyde bir miktar asit veya baz bulunur. Sabun, şampuan, deterjan gibi temizlik ürünlerinin yapımında çeşitli asit ve bazlar kullanılır. Aşağıda günlük hayatta kullandığımız ürünlerin pH değerleri verilmiştir.
Asitler
Sulu çözeltilerinde H+ iyonu veren maddeler asit olarak adlandırılır. Genellikle asitlerin formül yapısında hidrojen atomu (H) bulunur. Ancak, yapılarında H bulunmadığı hâlde CO2, NO2 ve SO2 maddeleri de asittir.

Asitlerin Suya Verdiği İyon

Günlük Hayatta Sıkça Karşılaştığımız Asitler
| Yiyecek / İçecek | İçerdiği Asit |
| Üzüm | Tartarik Asit |
| Sirke | Asetik Asit |
| Elma | Malik Asit |
| Ekşimiş Süt / Yoğurt | Laktik Asit |
| Limon | Sitrik Asit(Limon Tuzu) |
| Kola / Gazoz | Karbonik Asit |
| Karınca | Formik Asit |
| Çilek | Folik Asit |
| Turşu / Meyve Suyu | Benzoik Asit |
| Reçel | Sorbik Asit |
Fosforik asit: Gübrelerde ve ilaç yapımında kullanılır. Gıda koruyucu olarak ve gazlı içeceklerde kullanılmaktadır.
Hidroklorik asit: Banyo ve tuvaletlerde temizlik malzemesi olarak kullanılan bir asittir.
Sülfürik asit: Boya sanayisinde ve patlayıcı yapımında kullanılan bir asittir.
Not: Gazlı içecekler bol miktarda asit içermektedir. Bunun yanında gazlı içeceklerin çok fazla sayıda zararı bulunmaktadır. Gazlı içeceklerin bazı zararları aşağıdakilerdir:
- Gazlı içecekler bol miktarda asit içerir.
- Gazlı içeceklerde urunun raf ömrünü uzatmak amacıyla kullanılan bazı koruyucu maddeler egzama, astım gibi hastalıklara neden olabilir.
- Gazlı içeceklerde bulunan asit ve şeker, dişlere ve diş etlerine zarar verebilir.
- Gazlı içecekler, uzun vadede böbrek taşına ve diğer böbrek rahatsızlıklarına yol açabilir.
- Gazlı içecekler kalp, karaciğer ve beyin gibi önemli organların fonksiyonlarına zarar verebilir.
- Gazlı içecekler, kan basıncının artmasına neden olabilir.
- Gazlı içeceklere, obezite olma riskini artırır ve kalp damar hastalıklarına yol açabilir.
- Fazla miktarda gazlı içecek tüketimi şeker hastası olma riskini artırır.
- Fenolftalein, soluk sarı renkte, toz hâlinde bir bileşiktir. Asitlerin içerisine fenolftalein eklendiğinde renk değişimi gözlenmez.
- Turnusol, suda çözünen bir boyadır. Çözelti olarak veya bir filtre kâğıdına emdirilerek kullanılır. Bu kâğıda pH belirteci denir ve maddelerin asitlik-bazlığını ölçmek için kullanılır. Mavi turnusol kâğıdı asidik ortamlarda kırmızıya döner.
Sulu çözeltilerinde (OH)– iyonu veren maddeler baz olarak adlandırılır. Genellikle bazların yapısında hidroksit (OH) iyonu bulunur. Ancak, OH bulunmayan amonyak (NH3) ise bazdır. NH3 susuz baz olarak da adlandırılır.

Bazların Suya Verdiği İyon

Günlük Hayatta Sıkça Karşılaştığımız Bazlar
Sodyum hidroksit: Beyaz renkte ve nem çekici bir maddedir. Suda kolaylıkla çözünür; yumuşak, kaygan ve sabun hissi veren bir çözelti oluşturur. Sodyum hidroksit, endüstride birçok kimyasal maddenin yapımında; yapay ipek, sabun, kâğıt, tekstil, boya ve deterjan endüstrisinde kullanılır.
Potasyum hidroksit: Arap sabunu gibi bazı temizlik ürünlerinin yapımında kullanılır.
Kalsiyum hidroksit: Beyaz bir toz olup suda hamurumsu bir görünüş alır. Sönmemiş kirece su ilavesiyle elde edilir. Kireç ve çimento yapımında kullanılır.
Amonyak: Renksiz, kendine özgü keskin kokusu olan bir gazdır. Sıvı amonyak özellikleri bakımından suya benzer. Amonyak endüstride gübre, nitrik asit, üre, boya, ilaç ve plastik gibi organik madde imalatında kullanılır. Soğutucularda ve cam temizleme ürünlerinde bulunur.
Temizlik malzemelerinin üretiminde genellikle bazlar kullanılır. Bunun yanında Sodyum karbonat(çamaşır sodası), Sodyum sülfat (Na2SO4) ve Sodyum fosfat (Na3PO4) gibi maddelerin kir çıkarma özellikleri vardır. Piyasada satılan bulaşık deterjanlarının çoğunda bu maddeler bulunur.
Bazları asitlerden ayırt etmek için iki farklı yöntem kullanılır. Fenolftalein ve turnusol kâğıdı kullanmak.
- Fenolftalein, soluk sarı renkte, toz hâlinde bir bileşiktir. Bazların içerisine fenolftalein eklendiğinde pembe renk doluştuğu gözlenir.
- Turnusol, suda çözünen bir boyadır. Çözelti olarak veya bir filtre kâğıdına emdirilerek kullanılır. Bu kâğıda pH belirteci denir ve maddelerin asitlik-bazlığını ölçmek için kullanılır. Kırmızı turnusol kâğıdı bazik ortamlarda maviye döner.
Asitlerin Genel Özellikleri
|
Bazların Genel Özellikleri
|
| Tatları ekşidir. Her asidin tadına bakılmaz. | Suda çözündüğünde OH– iyonu verebilir. |
| Yakıcı özelliğe sahiptir. | Kırmızı turnusol kâğıdını maviye dönüştürür. |
| Suda çözündüğünde H+ iyonu verebilir. | Tatları acıdır. |
| Mavi turnusol kâğıdını kırmızıya dönüştürür. | Çözeltileri ele kayganlık verir. |
| Bazlarla birleşerek tuz ve su oluşturur. | Asitlerle tuz ve su oluşturur. |
pH bir çözeltinin asitlik veya bazlık derecesini tarif eden ölçü birimidir. Açılımı “Power of Hydrogen” (Hidrojenin Gücü)’dir. Asit ve bazların pH değerlerine bakarak o asit ve bazın kuvvetli ya da zayıf olduğunu söyleyebiliriz. pH değeri 0 – 14 arasındaki değerlerden oluşur. Bir çözeltinin ne kadar asidik veya ne kadar bazik olduğunun ölçüsü pH değeri ile ifade edilir. Saf suyun asitlik veya bazlık özelliği yoktur. Bu nedenle pH’ı 7’dir. pH’ı 0-7 arasında olan maddeler asidik, pH’ı 7-14 arasında olan maddeler ise bazik olarak sınıflandırılır. pH değeri sıfırdan 7’ye doğru yükseldikçe maddenin asitlik özelliği azalır. pH’ın 7 olması maddenin asitlik ve bazlık özelliğinin olmadığını gösterir. pH 7’den itibaren sayı yükseldikçe maddenin bazlık özelliği artar.
Maddelerin pH değerlerini ölçmek için turnusol kağıdı ve pH ölçeğinden yararlanılır. Ölçme işlemi iki aşamada gerçekleşir:
- Turnusol kağıdı maddenin içerisine daldırılır ve renk değişimi gözlenir.
- Turnusol kağıdı pH ölçeği ile karşılaştırıldığında aynı rengin bulunduğu yerdeki sayı o maddenin pH değeridir.

Turnusol Kağıdı ve pH ölçeği(skalası)
Kuvvetli asit ve bazlar yakıcı ve tahriş edici olup zehirlenmelere neden olabilir. Süt ve süt ürünlerinden sebze ve meyvelere, ekmekten deniz ürünlerine kadar hemen her şeyde bir miktar asit veya baz bulunur. Sabun, şampuan, deterjan gibi temizlik ürünlerinin yapımında çeşitli asit ve bazlar kullanılır. Aşağıda günlük hayatta kullandığımız ürünlerin pH değerleri verilmiştir.
Bazı Ürünlerin pH Değerleri
| |||||
| Ürün | pH Değeri | Ürün | pH Değeri | Ürün | pH Değeri |
| Fasulye | 4-6,5 | Maydanoz | 4,8-5,2 | Ekmek | 5-5,6 |
| Pancar | 4,2-4,4 | Elma | 2,9-3,3 | Tavuk eti | 6,2-6,4 |
| Lahana | 4,9-6 | Muz | 4,5-4,7 | Balık | 6,6-6,8 |
| Havuç | 5,6-6 | Marul | 6 | Bal | 5,6-6 |
| Patlıcan | 4-5,8 | İncir | 4,6 | Tereyağı | 6,1-6,4 |
| Kereviz | 5,7-6 | Portakal suyu | 3,6-4,3 | Yoğurt | 3,8-4,1 |
| Mısır | 7,3 | Greyfurt suyu | 3 | Sirke | 4-4,5 |
| Süt | 6-6,5 | Kavun | 6,3-6,7 | Yumurta akı | 7,6-9,5 |
| Patates | 5,3-5,6 | Erik | 2,8-4,6 | Yumurta Sarısı | 6-6,3 |
| Domates | 4,2-4,3 | Karpuz | 5,2-5,6 | Krema | 6,5 |
| Ispanak | 5,5-6 | Üzüm | 3,4-4,5 | Midye | 4,8-6,3 |
| Kırmızı soğan | 5,3-5,8 | Peynir | 4,9-6,1 | Karides | 6,8-7,8 |
Yorumlar
Yorum Gönder